

NOTA DE TAPA
SOLUCIONES MIC TAILOR MADE PARA INSTALACIONES DE SUPERFICIE EN YACIMIENTOS NO CONVENCIONALES
Este estudio presenta una metodología integral para mitigar la corrosión inducida por Halanaerobium, una bacteria nativa de Vaca Muerta. A través de ensayos en laboratorio y tratamientos en campo, se evaluaron biocidas efectivos y monitoreos avanzados, logrando reducir recuentos microbianos, velocidad de corrosión y la presencia del género target en líquidos de producción, todo con costos competitivos.
Por María Clara Pagliaricci, Graciela Rojas, Francisco Massello, Joaquín Dos Santos, Agustina. Piatti, Facundo Porcel de Peralta e Isabel Vega (Y-TEC).
SINOPSIS
El agua de flowback en yacimientos no convencionales presenta tanto en Argentina como en el mundo un microbioma rico en el género bacteriano Halanaerobium, diagnosticado por estudios metagenómicos del gen 16S ARNr. Esta bacteria es nativa de la formación Vaca Muerta (Argentina), donde se encuentra esporulada. No obstante, en las instalaciones de superficie, encuentra condiciones óptimas de crecimiento en forma planctónica y sésil ocasionando corrosión inducida por microorganismos (MIC). Los mecanismos que aceleran la corrosión por parte de este microorganismo son: la reducción de tiosulfato, produciendo sulfuros de hierro y H2S por vías de intermediarios químicos (CMIC) o en forma directa por transferencia de electrones (EMIC), la producción de ácidos orgánicos a partir de la fermentación y la formación de biofilms. Debido a esto, Halanaerobium es un género target a controlar en instalaciones de superficie de la producción no convencional.
En este estudio se presenta una metodología de Soluciones MIC Tailor Made en dos niveles: laboratorio y campo. En el laboratorio, se desarrollaron cultivos in vitro planctónicos y sésiles del género target y se seleccionaron formulaciones biocidas efectivas a través de killtest mediante ATP, fluorescencia y microscopía confocal. En campo, se diseñaron tratamientos de aplicación acompañando la dinámica de la producción y se implementaron monitoreos rápidos de la criticidad MIC mediante: recuentos por ATP, recuentos por qPCR específicos para el target, análisis de la diversidad microbiana completa por el estudio metagenómico del gen 16S ARNr con tecnología de nanoporos, caracterización espectroscópica de productos de corrosión y el seguimiento de la velocidad de corrosión mediante cupones de acero al carbono, de acuerdo a ASTM G1 y AMPP- NACE SP 775.
Finalmente, los resultados obtenidos de la aplicación de esta metodología en una planta de tratamiento de crudo No Convencional permitieron demostrar su efectividad. Se lograron los KPI deseados: disminución del recuento total de microorganismos, reducción de la velocidad de corrosión y eliminación de la presencia del género target en las corrientes líquidas a un costo total de aplicación competitivo.
INTRODUCCIÓN
Argentina ocupa el segundo lugar a nivel mundial en términos de Gas No Convencional (Shale Gas) técnicamente recuperable y el cuarto en Petróleo No Convencional (Shale Oil). El Shale (Exquisito) más prolífico es la formación Vaca Muerta. La productividad de Vaca Muerta se compara con algunos de los mejores yacimientos de Shale de EE. UU., como Eagle Ford y Marcellus. Vaca Muerta contiene 1202 Tcf de gas y 270 mil millones de barriles de petróleo en reservas en el lugar. Se estima que 308 Tcf y 16 mil millones de barriles de estos recursos son técnicamente recuperables (EIA 2015). La producción no convencional en Argentina en 2023 representó el 45% del petróleo total producido en el país y el 39% del total de gas. Los indicadores de volúmenes mensuales en Argentina para abril de 2024 arrojaron los siguientes números: 17 Millones de m3 mensuales de Shale Oil y 216.000 m3 mensuales de Tight Oil, mientras que en Gas se reportaron 19 mil de millones de m3 mensuales de Shale Gas y casi 6 mil de millones de m3 mensuales de Tight Gas1.
La extracción no convencional se realiza mediante fractura hidráulica (“fracking”) que consiste en inyectar por la tubería de producción un fluido compuesto por agua, arena y aditivos, liberando de esta manera los hidrocarburos. Luego, al poner estos pozos en producción se genera una corriente de fluido multifásico (gas, petróleo y agua) que es separada y tratada en las instalaciones de superficie: Early Production Facility (EPF), Baterías, Plantas de Tratamiento de Crudo (PTC) y Plantas de Inyección de Agua (PIA). El corte de agua de esta corriente es de alrededor del 20% y se la conoce como agua de retorno o flowback, siendo las características fisicoquímicas promedio: Conductividad 120.000 µS/cm2, TDS 77000 ppm, pH: 5,46 a 25°C. (Vargas et al. 2017a).
A pesar de estas condiciones extremas, el agua de flowback en Argentina presenta una actividad microbiana rica en un género bacteriano Halanaerobium (Vargas et al. 2021b), consistente con lo reportado en la producción No Convencional de Estados Unidos (Murali Mohan et al. 2013a, Cluff et al.2014, Geissler et al. 201). Esta bacteria halófila es nativa de las formaciones de Shale en el mundo por su capacidad de biodegradación de materia orgánica, la producción de sulfuro (Akob et al. 2015, Liang et. al. 2016) y la resistencia a las condiciones de reservorio mediante esporulación (Jones et. al 2020) para luego encontrar condiciones óptimas de crecimiento en superficie (Daly et al. 2016; Davis et al. 2012; Gaspar et al. 2014; Lipus et al. 2017; Mouser et al. 2016). El análisis del genoma de este género aislado ha revelado la presencia conservada de proteínas similares a la rodanasa y complejos anaeróbicos de sulfito reductasa capaces de convertir tiosulfato en sulfuro. Adicionalmente los estudios proteómicos verificaron que estas proteínas eran más abundantes cuando el tiosulfato está presente en el crecimiento, generando sulfuros y ácidos orgánico, sugiriendo una ruta fermentativa donde se utiliza el tiosulfato para eliminar el exceso reductor (Booker et al., 2017)
1 Secretaría de Energía Argentina (2024, Abril) Panel de indicadores de energía producción de gas y petróleo No Convencional. https://www.argentina.gob.ar/economia/energia/planeamiento- energetico/panel-de-indicadores/superset-prod-gas-conv-y-no-conv
Los mecanismos que aceleran la corrosión de acero al carbono por parte de este microorganismo son: la reducción de tiosulfato, produciendo sulfuros de hierro y H2S por vías de intermediarios químicos, CMIC, o en forma directa por transferencia de electrones, EMIC, (Enning et al. 2013). Además de la producción de ácidos orgánicos a partir de la fermentación y la formación de biofilms. En el trabajo de Soler et al. 2021, se ha estudiado la capacidad de formar biofilms y la criticidad MIC de esta bacteria asociada con un mecanismo EMIC.
En base a lo expuesto, el género Halanaerobium es un microorganismo target en las instalaciones de superficie no convencional y requiere de una estrategia de mitigación para reducir los fenómenos MIC asociados.
DESARROLLO
Instalación
Para el desarrollo de esta Solución MIC para yacimientos no convencionales (NoC) se seleccionó una Planta de Tratamiento de Crudo (PTC) del reservorio de Vaca Muerta en la Cuenca Neuquina. En la Figura 1 se presenta el circuito de agua de flowback de la PTC estudiada, cuyo caudal de agua tratada es 100 m3/h.

Figura 1. Circuito de agua de flowback en PTC de producción no convencional.
Metodología.
⦁ En Laboratorio.
Determinación de recuentos de microorganismos totales viables por ATP.
Para la determinación de ATP se utilizaron métodos de Bioluminiscencia de 2° generación (ASTM D6787-11) utilizando los kits comerciales (LuminUltra®): Quench-Gone Organic Modified (QGO-M TM), para muestras liquidas y Deposit & Surface Analysis (DSA TM), para depósitos y cupones.
Extracción de ADN.
La extracción de ADN de las muestras de agua de flowback necesitó un acondicionamiento previo:
⦁ Eliminación de bases orgánicas por incubación a 40°C y separación con solventes, por ejemplo, Xileno
⦁ Concentración de la biomasa del agua separada por filtración en vacío con membranas de nylon de 0,22 µm. Las membranas se conservaron a -18°C para el posterior procesamiento.
Mientras que las muestras solidas (productos de corrosión de cupones y depósitos) se procesaron tal cual.
Para la extracción de ADN se utilizó el kit comercial NucleoSpin Soil TM (Macherey- Nagel®). Luego el ADN extraído fue cuantificado por Nanodrop y Qubit.
Determinación de recuentos microbianos por qPCR
La estimación de la concentración de Bacterias Totales, Halanaerobium y Bacterias Sulfato Reductoras (BSR) en las muestras analizadas se realizó mediante curvas de calibración por PCR en tiempo real (qRT-PCR), donde se relacionó la emisión de fluorescencia con el número de microorganismos por unidad de volumen o masa de depósito. Se utilizó un equipo de detección iCycler iQ (Bio-Rad®) y el colorante intercalante SYBRGreen I (Invitrogen®) como reportero fluorescente. En esta técnica se usan marcadores generales, taxonómicos y funcionales. Por ejemplo, para Bacterias se utilizó el gen 16S ARNr, para Halanaerobium se utilizó la secuencia Rodanasa de especies de esta bacteria que cataliza la tiosulfato reducción y para BSR el marcador dsrAB. Las etapas del ensayo fueron: amplificación del ADN por termociclado, tinción del ADN en solución con baja fluorescencia y la emisión de fluorescencia por la marcación del gen de interés.
Análisis Metagenómico por Tecnología de Nanoporos
El análisis metagenómico del gen 16S ARNr a partir del ADN obtenido se realizó con la Tecnología de Nanoporos utilizando el equipamiento MinION 1KC (MIN 101 C Oxford Nanopore Technologies®), con la preparación de librerías mediante Rapid Sequencing DNA - 16S Barcoding Kit 24 V14 (Oxford Nanopore Technologies®), el Secuenciamiento con flonge
cells (R9.4.1 Oxford Nanopore Technologies®) y el análisis para la obtención de un basecalling adecuado.
Análisis Bioinformático y clasificación MIC.
La metodología se basa en la pipeline oficial de Oxford Nanopore Technologies para el análisis de datos 16S: (https://github.com/epi2me-labs/wf-metagenomics ) pero se adaptó para correrse OFFline y para generar tablas y gráficos de géneros, metabolismos y MIC role, utilizando bases de datos customizadas: Genbank propio del historial realizado por YTEC con la clasificación de criticidad MIC según metabolismos y antecedentes en bibliografía de más de 2000 muestras analizadas en O&G. Los resultados que se obtienen son una tabla de géneros presentes en la muestra (diversidad microbiana) en porcentajes relativos con la criticidad MIC y el metabolismo asociado.
Consorcios microbianos in vitro ricos en Halanaerobium planctónicos.
La concentración de microorganismos provenientes de las aguas de flowback se llevó a cabo filtrando 800 mL de agua a través de un papel filtro de 0.22 µm de acetato de celulosa. Los microorganismos retenidos en el filtro se suspendieron en 15 mL del agua microfiltrada anteriormente y se los incubaron en shaker a 34°C 150 rpm 24 hs para obtener un inóculo enriquecido. Posteriormente este inóculo se cultivó en las condiciones del medio propuesto por Jones et al. 2020 modificado según Tabla 1 para favorecer el enriquecimiento en Halanaerobium. Los cultivos se burbujean en nitrógeno para lograr anaerobiosis y se mantuvieron en shaker a 150 rpm y 34°C.

Tabla 1 – Medio de Cultivo Jones Modificado.
El enriquecimiento fue corroborado por ATP, qPCR del gen de Halanaerobium y análisis metagenómico del gen 16S ARNr con Tecnología de Nanoporos.
Consorcios microbianos in vitro ricos en Halanaerobium, biofilm.
El desarrollo de biofilms ricos en Halanaerobium fue llevado a cabo en reactores CDC (Biosurfase®) a partir de cultivos plantónicos ricos en la bacteria de interés, realizando un crecimiento en el medio detallado en Tabla 1. El diseño del sistema se esquematiza en la Figura
2. El reactor se colocó en agitador a 300 rpm y 33°C con alimentación de nitrógeno (150 cm3/min) durante 16 horas (overnight) para generar atmósfera anaeróbica y luego se inoculó al 10%. El Biorreactor estuvo provisto de 21 cupones de acero al carbono SAE 1040 en sus barras como se observa en la Figura 3.

Figura 2. Esquema de generación de biofilm in vitro rico en Halanaerobium.

Figura 3. Imagen del reactor CDC en fase Batch.
El crecimiento en batch se siguió a través de la determinación de ATP (LuminUltra®), la densidad óptica a 600 nm, el consumo de glucosa (Megazyme®), la variación de pH y el potencial redox. Además, se hicieron análisis por cromatografía iónica para cuantificación de tiosulfato y otras especies azufradas, así como también, la aparición de picos en la región de los ácidos orgánicos de bajo peso molecular.
Se realizó una curva de correlación entre la determinación de ATP y la densidad óptica para hacer el seguimiento del reactor a través de esta última y prescindir del kit de ATP.
Tras cuatro días de crecimiento en batch, el cultivo alcanzó la fase estacionaria de crecimiento, al quinto día, el sistema se pasó a alimentación continua (Figura 4). La velocidad de flujo se estableció como 1,5 veces la µMax determinada. De esta manera, se favoreció la adhesión de los microorganismos a las superficies mientras que los microorganismos plantónicos fueron lavados.
El seguimiento del sistema en continuo se realizó a través de las mismas medidas que durante el cultivo en batch.

Figura 4. Imagen del reactor CDC en fase continua.
Al cabo de un mes de cultivo, se obtuvo biofilm en cupones para realizar ensayos de kill test y evaluación mediante ATP, fluorescencia y microscopía confocal.
Kill test.
La evaluación del efecto biocida de los productos desarrollados en consorcios in vitro ricos en Halanaerobium plantónicos y sésiles fue determinado por Bioluminiscencia, ATP, ya descripto, y por Fluorescencia mediante un espectrofluorómetro utilizando el kit de ThermoFisher® Live/Dead BacLight Bacterial Viability Kit (L7007).
Se evaluaron blancos, consorcios sin dosificación de producto biocida respecto a consorcios tratados en distintas concentraciones y tiempos de productos biocidas para obtener las concentraciones mínimas inhibitorias (CMI) y el efecto residual.
Microscopía confocal (CLFM) y análisis de imágenes.
Los cupones del biorreactor fueron retirados en flujo laminar, enjuagados con 1 ml de solución de NaCl al 10% y teñidos con 30 µL de premezcla de fluoróforos Syto9:IP (1:0.5) luego se almacenaron en oscuridad por 25 min y se los tiñó con 20 µL de CalcoFluor White y al minuto se le agregó 20 µl de KOH 10% preservándolos a 4°C. Luego estos cupones fueron analizados en el microscopio confocal LSM 900 Zeiss, objetivo al aire 10X con cortes cada 4 µm en la más representativa.
El análisis de las imágenes adquiridas se realizó utilizando el software FIJI siguiendo un protocolo ad-hoc. En el mismo se analizó la intensidad de fluorescencia, el área cubierta y el volumen ocupado.
⦁ En Campo.
Determinación de línea base del microbioma presente.
En la instalación se seleccionaron los puntos críticos de control: Ingreso de Planta (agua de producción), Salida de Tanque Skimmer Operativo (agua de producción y cupón de acero al carbono), Salida de Pulmón de Agua Operativo (agua de producción y cupón de acero al carbono), Pozo sumidero 1 (agua de producción y residuos de filtro de inyección).
Se caracterizó el recuento microbiano de células totales viables por ATP y el recuento microbiano de bacterias totales, BSR y Halanaerobium por qPCR, mientras que la diversidad microbiana total y su criticidad MIC fue evaluada por el análisis metagenómico. La velocidad de corrosión fue caracterizada por gravimetría ASTM G01/ SP AMPP 775 y los residuos fueron caracterizados por difracción de rayos X, DRX, barrido elemental, WXRF y microscopía de barrido electrónico, SEM.
Diseño de piloto industrial.
Se realizó un piloto industrial durante 60 días en la PTC descripta del producto desarrollado por YTEC, Y-EXP 01 BIO, producido y aplicado por YPF Química.
El diseño de la aplicación fue realizado en conjunto con los referentes de la instalación a partir de un balance de masa de producto en el Tanque Skimmer y Tanque Pulmón de agua en serie para garantizar CMI y tiempo de batcheo obtenidos de laboratorio. La frecuencia de batcheos siguió dos esquemas, el primero: 3 veces por semana lunes, miércoles y viernes, y el segundo: lunes y jueves.
Además, se definieron como KPIs: la disminución de la carga microbiana en la salida de planta, la disminución de la velocidad de corrosión en los cupones de corrosión y la disminución de solidos totales suspendidos, TSS, en la salida de planta.
Monitoreo.
El monitoreo consistió en el seguimiento diario de lunes a sábado de ATP en el agua de producción de Ingreso de Planta, Salida Tanque Skimmer Operativo, Salida Tanque de Agua y Pozo Sumidero. Adicionalmente, cada 15 días se realizó qPCR y análisis metagenómico en todos los PCC seleccionados antes y después de la aplicación del biocida. Se complementó con la determinación de la velocidad de corrosión y la caracterización de residuos con una frecuencia mayor, superior a 30 días.
Resultados
Diagnóstico inicial de la criticidad MIC en la Instalación No Convencional.
En la Figura 5 y 6 se grafican los recuentos microbianos en los PCC de la instalación de estudio, PTC No Convencional, de muestras plantónica y sésiles, respectivamente.

Figura 5. Recuentos Microbianos en muestras Planctónicas.
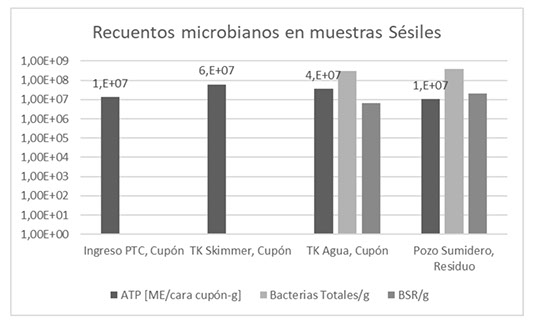
Figura 6. Recuentos Microbianos en muestras Sésiles.
En las Figuras 7 a la 12 se expone la diversidad de bacterias de los PCC analizados en muestras plantónica y sésiles por análisis metagenómico y su criticidad MIC.
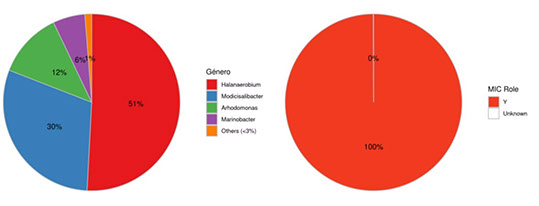
Figura 7. Diversidad de Bacterias en Ingreso a PTC, muestra plantónica.

Figura 8. Diversidad de Bacterias en Salida Tanque Skimmer, muestra plantónica.
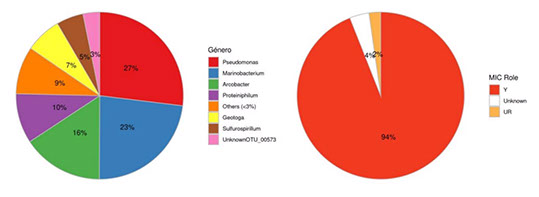
Figura 9. Diversidad de Bacterias en Salida Tanque de Agua, muestra plantónica.

Figura 10. Diversidad de Bacterias en Salida Tanque de Agua, cupón, muestra sésil.
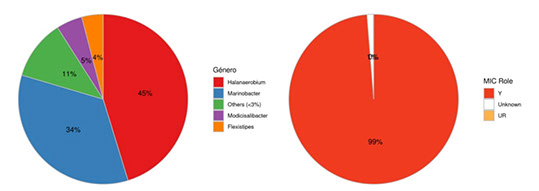
Figura 11. Diversidad de Bacterias en Pozo Sumidero, muestra plantónica.

Figura 12. Diversidad de Bacterias en Pozo Sumidero, residuo, muestra sésil.
Evaluación por Kill test de ATP del biocida Y EXP 01 BIO en consorcio in vitro plantónico rico en Halanaerobium.
En la Figura 13 se exponen los resultados de la capacidad biocida de Y-EXP 01 BIO, 300 ppm, en un consorcio in vitro plantónico con recuento de Halanaerobium mayor a 1x 105 Cel/ml por qPCR, corroborado por análisis metagenómico con una abundancia relativa superior al 90%.
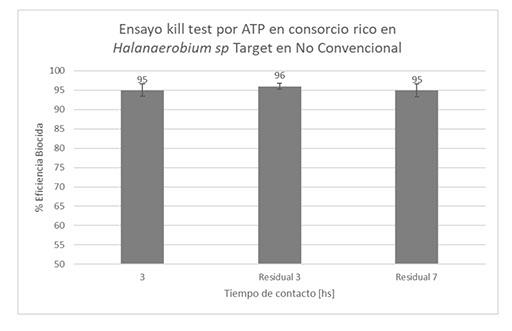
Figura 13. Capacidad biocida de Y EXP 01 BIO, 300 ppm, en consorcios plantónicos in vitro ricos en Halanaerobium.
Evaluación por microscopia confocal (CLFM) de la eficiencia del biocida Y- EXP 01 BIO e Y- EXP 02 BIO en consorcio in vitro sésil rico en Halanaerobium.
A continuación, se presentan las imágenes de microscopia confocal del biofilm generado durante 21 días en el reactor CDC con un recuento de microorganismos viables de 7,5x109 ME/cm2 cuya composición por análisis metagenómico fue 99% de Halanaerobium.
En la Figura 14 se muestra un biofilm desarrollado de gran espesor en la superficie del cupón con un volumen máximo de 3,6x108 µm3 y un espesor de 260 µm, presentando células muertas en el control o blanco (color rojo).

Figura 14 – CLFM de los cupones tras 21 días de incubación. Superposición de las tinciones con Syto9 (células totales) y Ioduro de propidio (IP) (células dañadas). A la derecha proyecciones en 3D de las imágenes, en rojo y amarillo células dañadas, en verde, células viables.
En la tinción con CalcoFluor White se visualiza el exapolisacáridos (EPS), matriz del biofilm. En la Figura 15 se muestran las células (verdes) embebidas en la matriz de EPS (azul) característico de biofilms maduros.

Figura 15 – Imágenes de superposición de fluorescencia de Syto9, verde, (células totales) y CalcoFluor White, azul/turqueza (CFW) (EPS). A la derecha, proyecciones en 3D de las imágenes en donde se aprecia en turquesa y verde la localización de las células dentro de la matriz de EPS.
Se evaluaron dos productos biocidas desarrollados por YTEC, Y-EXP 01 BIO y Y-EXP 02 BIO en población plantónica y con mayor concentración (1000 ppm) para seleccionar el más adecuado para testear en el biofilm desarrollado. Los resultados de killtest por fluorescencia se exponen en Tabla 2.
Tabla 2 – Resultados Kill Test por Fluorescencia en población plantónica.

Los ensayos en biofilm se llevaron a cabo con el producto más efectivo Y-EXP 02 BIO. En las figuras 16 y 17 se exponen los resultados del control y el sistema con Y-EXP 02 BIO, respectivamente.

Figura 16 – Análisis de imágenes del Control. A) Superposición de fluorescencia de células vivas (verdes), muertas (rojas) y EPS (azul). B) Intensidad de fluorescencia (RFU) en función de la distancia desde la superficie del cupón para las tres señales. C) Representación volumétrica del biofilm obtenido, se muestran las tres fluorescencias superpuestas, siendo turquesa la yuxtaposición de verde y azul (células vivas y EPS).

Figura 17 – Análisis de imágenes del sistema con Y-EXP 02 BIO. A) Superposición de fluorescencia de células vivas (verdes), muertas (rojas) y EPS (azul). B) Intensidad de fluorescencia (RFU) en función de la distancia desde la superficie del cupón para las tres señales. C) Representación volumétrica del biofilm obtenido, se muestran las tres fluorescencias superpuestas, siendo naranja la yuxtaposición de rojo y verde (células muertas y células vivas).
Piloto de campo
El piloto de campo fue llevado a cabo durante 60 días aplicando el producto Y-EXP 01 BIO en la PTC de estudio.
El producto fue dosificado a la salida del Free Water 1 de la Figura 1 en dos esquemas de batcheos:
⦁ Esquema 1: Lunes, Miércoles y Viernes.
⦁ Esquema 2: Lunes y Jueves.
Manteniendo en ambos esquemas el mismo consumo de producto semanal, con el objetivo de cumplir los siguientes KPIs:
⦁ Mantener el recuento y % de criticidad MIC (o bajar) en el agua de inyección a pozo sumidero.
⦁ Mantener % de criticidad MIC o disminuirlo en cupones de corrosión.
En la Figura 18 se exponen los logaritmos del recuento de microorganismos viables totales por ATP previos y durante el piloto de 60 días. Mientras que en la Figura 19 se grafica la diferencia logarítmica del recuento de Salida de Planta e Ingreso de planta, indicando un valor positivo un incremento de carga a la salida y un valor negativo una reducción de carga.

Figura 18 – Logaritmo del recuento de microorganismos totales viables por ATP, previo al piloto y durante el piloto en Ingreso de Planta y Pozo Sumidero.
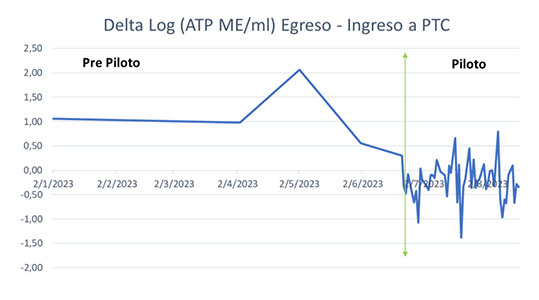
Figura 19 – Diferencia logarítmica de recuento de microorganismos totales viables por ATP entre egreso e ingreso de la PTC.
En la Figura 20 se grafican los recuentos de Bacterias Totales a lo largo del tratamiento, observándose incrementos en los tanques respecto a los ingresos, fuentes de diversidad/variabilidad, y una disminución en el egreso coincidente con el recuento por ATP.

Figura 20 – Recuentos de Bacterias Totales por qPCR en los PCC de la PTC a lo largo del piloto.
En Figura 21 se representan los recuentos de BSR y Halanaerobium a lo largo del tratamiento, observándose una reducción en el tanque pulmón de agua y en pozo sumidero, con una respuesta positiva del biocida.

Figura 21 – Recuentos de BSR y Halanaerobium por qPCR en los PCC de la PTC a lo largo del piloto.
En la Figura 22 se grafican los resultados de diversidad de bacterias en porcentaje relativo en los distintos PCC a lo largo del piloto, donde se observa la disminución de Halanaerobium en el sistema, pero el incremento del género Marinobacter, Nitrato Reductora, también asociada a MIC.
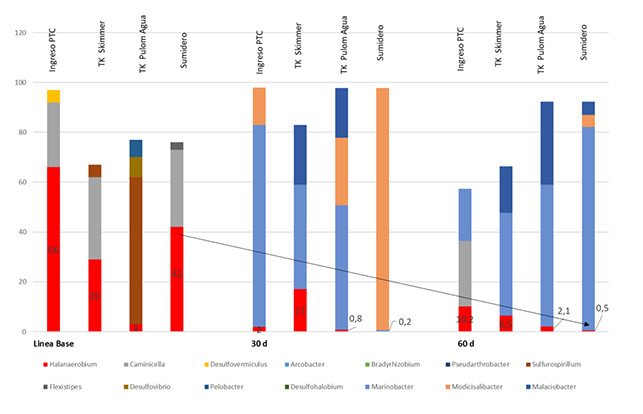
Figura 22 – Diversidad de bacterias por análisis metagenómico en los PCC a lo largo del piloto.
En la Figura 23 se evidencia los valores de velocidad de corrosión obtenidos en los cupones alojados en el tanque de Agua entre 15 y 45 días de exposición según ASTM G01 y SP AMPP 775. La velocidad de corrosión se reduce un 40%, disminuyendo la criticidad de alto a moderado, demostrando una buena performance del tratamiento.

Figura 23 – Velocidad de corrosión observada a lo largo del piloto.
Finalmente, en la Figura 24 se exponen los sólidos totales suspendidos evaluados a lo largo de la PTC, indicando en color verde los resultados del piloto en comparación con los datos azules pre piloto.

Figura 24 – Solidos Totales Suspendidos [ppm] a lo largo de la PTC pre y post piloto.
La caracterización de sólidos por DRX no permitió cuantificar sulfuros de hierro (SxFey) pero se detectó cualitativamente S y Fe por WXRF. En SEM se observaron regiones con S y Fe que podrían indicar su presencia deslocalizada y no mayoritaria de sulfuros de hierros subproducto de los mecanismos MIC asociados al género Halanaerobium, tiosulfato reductor.
Análisis de resultados.
La PTC No Convencional estudiada en este trabajo presentó en su diagnóstico inicial una criticidad MIC elevada en el circuito de agua de flowback. Los recuentos de microorganismos viables totales por ATP fueron mayores a 1 x104 ME/ml en todos los PCC plantónicos, coincidentes en el orden de magnitud del recuento microbiano de Bacterias Totales por qPCR. Sin embargo, el recuento de Bacterias Sulfato Reductoras no fue significativo en los PCC plantónicos analizados que se complementa con la diversidad de bacterias que se encontró por análisis metagenómico que expresó la presencia mayoritaria del género asociado a MIC Halanaerobium. Esta bacteria es reductora de tiosulfato y productora de ácidos. Por otro lado, la población sésil en cupones y depósitos presentó una mayor carga microbiana en al menos dos órdenes de magnitud respecto a la plantónica, con una mayor presencia de BSR pero siguiendo la presencia mayoritaria de Halanaerobium en los residuos de biofilm a pozo sumidero. De esta manera se determinó que la instalación presentó un género target a mitigar, Halanaerobium, por su criticidad MIC en ambos tipos de poblaciones (plantónicas y sésiles).
La confección de consorcios in vitro plantónicos y sésiles permitió disponer de una matriz para los ensayos Kill Test logrando seleccionar y desarrollar de biocidas por parte de YTEC.
El producto Y-EXP BIO 01 logró en laboratorio una correcta performance, reducción de más de un logaritmo de carga microbiana en kill tets de ATP a dosis de 300 ppm con 3 horas de batch y efecto residual. Mientras que los resultados del piloto de campo fueron los siguientes:
⦁ Reducción de la carga microbiana en la salida respecto al ingreso de la PTC, mejorando la performance del tratamiento pre piloto.
⦁ Reducción de Bacterias Sulfato Reductoras y Halanaerobium en Tanque de Agua y salida a pozo sumidero, egresos del sistema.
⦁ Reducción de velocidad de corrosión en un 40% a lo largo del piloto en los cupones instalados en tanque de almacenamiento de agua de flowback.
⦁ Reducción de Sólidos Totales Suspendidos en el primer mes de tratamiento con presencia no mayoritaria de sulfuros de hierro.
No obstante, el porcentaje de criticidad MIC en la instalación se mantiene constante por el cambio de microbioma presente y la perseverancia del género Marinobacter, nitrato reductor, asociado a MIC (Shi et. al. 2023).
A nivel de biofilms, en laboratorio, el producto Y-EXP 02 BIO es más efectivo que el producto Y-EXP 01 BIO siendo un producto alternativo para testear en el futuro en la instalación ajustando el diseño de tratamiento para contrarrestar la criticidad MIC aún presente, fortaleciendo la Solución MIC para NoC diseñada.
CONCLUSIONES
La Solución MIC Tailor Made para yacimientos No Convencionales evaluada en este trabajo logra los KPI deseados: disminución del recuento total de microorganismos, reducción de la velocidad de corrosión y eliminación de la presencia del género target Halanaerobium a un costo total de aplicación competitivo.
No obstante, el porcentaje de criticidad MIC en la instalación se mantiene constante por el cambio de microbioma presente y la perseverancia del género Marinobacter, nitrato reductor que fue evidenciado por un correcto monitoreo en campo mediante ATP, qPCR y análisis metagenómico.
Debido a esto, la Solución MIC propuesta permite un tratamiento integral de la problemática con la conjunción del desarrollo de químicos, la aplicación y monitoreo tailor made que garantiza la efectividad de la mitigación en el tiempo.
A futuro se trabajará con la alternancia de productos biocidas, incorporando el producto Y-EXP 02 BIO más efectivo en biofilms y rediseñado la ampliación para mitigar los nuevos targets emergentes.
REFERENCIAS
Akob, D. M., Cozzarelli, I. M., Dunlap, D. S., Rowan, E. L., and Lorah, M. M. (2015). Organic and inorganic composition and microbiology of produced waters from Pennsylvania shale gas wells. Appl. Geochem. 60, 116–125. doi: 10.1016/j.apgeochem.2015.04.011
ASTM Standard Test Method D7687 – 17, Measurement of Cellular Adenosine Triphosphate in Fuel and Fuel-associated Water With Sample Concentration by Filtration (www.astm.org).
ASTM Standard Test Method G01 – 03 (2017), Standard Practice for Preparing, Cleaning, and Evaluating Corrosion Test Specimens (www.astm.org).
Booker AE, Borton MA, Daly RA, Welch SA, Nicora CD, Hoyt DW, Wilson T, Purvine SO, Wolfe A, Sharma S, Mouser PJ, Cole DR, Lipton MS, Wrighton KC, Wilkins MJ. 2017. Sulfide generation by dominant Halanaerobium microorganisms in hydraulically fractured shales. mSphere 2:e00257-17. https://doi.org/10.1128/mSphereDirect.00257-17 .
Cluff, M. A., Hartsock, A., Macrae, J. D., Carter, K., and Mouser, P. J. (2014). Temporal changes in microbial ecology and geochemistry in produced wáter from hydraulically fractured marcellus shale gas wells. Environ. Sci. Technol. 48, 6508–6517. doi: 10.1021/es501173p
Daly RA, Borton MA, Wilkins MJ, Hoyt DW, Kountz DJ, Wolfe RA,Welch SA, Marcus DN, Trexler RV, MacRae JD, et al. 2016.Microbial metabolisms in a 2.5-km-deep ecosystem created byhydraulic fracturing in shales. Nat Microbiol. 1:16146.
Davis JP, Struchtemeyer CG, Elshahed MS. 2012. Bacterial communities associated with production facilities of two newly drilled thermogenic natural gas wells in the Barnett Shale (Texas, USA).Microb Ecol. 64:942–954.
EIA. (2015, March 18, 2020). Technically Recoverable Shale Oil and Shale Gas Resources: Argentina Septiembre 24, 2015. https://www.eia.gov/analysis/studies/worldshalegas/pdf/Argentina_2013.pdf
Enning D, Garrelfs J. Corrosion of iron by sulfate-reducing bacteria: new views of an old problem. Appl Environ Microbiol. 2014 Feb;80(4):1226-36. doi: 10.1128/AEM.02848-13. Epub 2013 Dec 6. PMID: 24317078; PMCID: PMC3911074.
Gaspar J, Mathieu J, Yang Y, Tomson R, Leyris JD, Gregory KB, Alvarez PJJ. 2014. Microbial dynamics and control in shale gas production. Environ Sci Technol Lett. 1:465–473.
Geissler, Brett, De Paula, Renato, Keller-Schultz, Carrie, Lilley, Jennifer, and Vic Keasler. "Data Mining to Prevent Microbiologically Influenced Corrosion?." Paper presented at the CORROSION 2014, San Antonio, Texas, USA, March 2014.
Jones, A. A., Pilloni, G., Claypool, J. T., Paiva, A. R., & Summers, Z. M. (2021). Evidence of sporulation capability of the ubiquitous oil reservoir microbe Halanaerobium congolense. Geomicrobiology Journal, 38(4), 283–293. https://doi.org/10.1080/01490451.2020.1842944
Liang R, Davidova IA, Marks CR, Stamps BW, Harriman BH, Stevenson BS, Duncan KE and Suflita JM (2016) Metabolic Capabilityof a Predominant Halanaerobium sp.in Hydraulically Fractured Gas Wells and Its Implication in Pipeline Corrosion. Front. Microbiol. 7:988. doi: 10.3389/fmicb.2016.00988 Lipus D, Vikram A, Ross D, Bain D, Gulliver D, Hammack R, Bibby K. 2017. Predominance and metabolic potential of Halanaerobium spp. in produced water from hydraulically fractured marcellus shale wells. Appl Environ Microbiol. 83: 2659–2675.
Mouser PJ, Borton M, Darrah TH, Hartsock A, Wrighton KC. 2016.Hydraulic fracturing offers view of microbial life in the deep terrestrial subsurface. FEMS Microbiol Ecol. 92:fiw166.
Murali Mohan, A., Hartsock, A., Bibby, K. J., Hammack, R. W., Vidic, R. D., and Gregory, K. B. (2013a). Microbial community changes in hydraulic fracturing fluids and produced water from shale gas extraction. Environ. Sci. Technol. 47, 13141–13150. doi: 10.1021/es40 2928b
SP0775-2013 Estándar Practice AMPP: “Preparation, Installation, Analysis, and Interpretation of Corrosion Coupons in Oilfield Operations” (www.ampp.org ).
Shi, W., Evans, P., Scheffer, G., y Casey H. "Novel Application of Nitrate as H2S Control Strategy in Permian Basin Produced Water Storage Ponds." Paper presented at the AMPP Annual Conference + Expo, Denver, Colorado, USA, March 2023.
Soler Arango J., Saavedra, A. U., Pagliaricci, M. C., Fernández, F. A., Morris, W., and W. A. Vargas. "Identification and Characterization of Planktonic and Sessile Consortium Associated with Microbiologically Influenced Corrosion (MIC) In the Oil and Gas Industry." Paper presented at the CORROSION 2021, Virtual, April 2021.
Vargas W, Pagliaricci M., González M., Montero C., Carfi G. y Morris W. (2017)a. Diagnóstico por Biología Molecular para la mitigación de la Biocorrosión en instalaciones de petróleo y gas. Revista Petrotecnia (Agosto 2017).
Vargas, W. A., Soler Arango J., Pagliaricci, M., Saavedra, A., y Morris W (2021)b. "The 1000's of Microbial Genera Found in Argentina's O&G Fields: Their Impact on Microbially Induced Corrosion and Integrity of Facilities." Paper presented at the CORROSION 2021, Virtual, April 2021.




> SUMARIO DE NOTAS
RIDA – EVOLUCIÓN DE LA FRECUENCIA DE FALLA EN EL PERÍODO 2009-2023 EN DUCTOS DE ARGENTINA
INTEGRACIÓN DE MÚLTIPLES CARRERAS ILI
CRUCES DE RÍOS: ANÁLISIS DE RIESGO HÍDRICO CUANTITATIVO
ANÁLISIS DE FALLA Y CAUSA RAÍZ. ROTURA EN DERIVACIÓN
REVISIÓN CRÍTICA DEL ESPACIAMIENTO ENTRE VÁLVULAS EN LA GESTIÓN DE INTEGRIDAD DE GASODUCTOS
SOLUCIONES MIC TAILOR MADE PARA INSTALACIONES DE SUPERFICIE EN YACIMIENTOS NO CONVENCIONALES
> Ver todas las notas

